[dropcap]S[/dropcap]eguim amb bioquímica, l’últim dia varem veure els aminoàcids. Si tenim clar què son, podem donar pas a les proteïnes, que es formen a partir de combinacions d’aquests aminoàcids i que, com ja sabreu, són un dels tres macronutrients essencials dels aliments.
El cos humà les utilitza com a matèria prima per a construir les cèl·lules, reparar els teixits de l’organisme i transportar altres nutrients pel torrent sanguini, així com per expressar els gens. Si pensem en nosaltres mateixos com un edifici, probablement les proteïnes serien les “totxanes” i altres materials extra que el conformen -els seus blocs constructors. I depenent del tipus de totxanes i la disposició dels materials, li donaríem una aparença única al nostre “edifici”.
Estructura primària
L’estructura primària d’una proteïna ve determinada per la seqüència d’aminoàcids en la seva cadena proteica, és a dir, el nombre d’aminoàcids que hi ha a la cadena i l’ordre en el que estan enllaçats.
 Recordem de l’entrega anterior que hi havia aminoàcids que poden formar proteïnes i aminoàcids que no. Bé, doncs si ens centrem en els que si en poden formar, veiem que la combinació que es realitzi d’aquests aminoàcids donarà lloc a diferents tipus de proteïnes.
Recordem de l’entrega anterior que hi havia aminoàcids que poden formar proteïnes i aminoàcids que no. Bé, doncs si ens centrem en els que si en poden formar, veiem que la combinació que es realitzi d’aquests aminoàcids donarà lloc a diferents tipus de proteïnes.
En una de les entrades passades sobre els gens varem posar alguns símils amb un llibre i les seves lletres, paraules i frases. Crec que en aquest cas el símil també ens pot funcionar força bé per a aclarir conceptes: podríem pensar en els aminoàcids com en les lletres que, juntes i en combinacions diferents, formarien diferents paraules.
Generalment, el nombre d’aminoàcids que formen una proteïna oscil·la entre els 80 i 300, els quals s’uneixen entre ells mitjançant enllaços peptídics. Aquí els apunts donen una descripció breu sobre l’enllaç peptídic, posen cara de que no ha passat res i continuen tant amples (uuuhhh, xiulets!), però a mi em sembla que ens hauríem de parar i preguntar-nos…
Què és un enllaç peptídic?
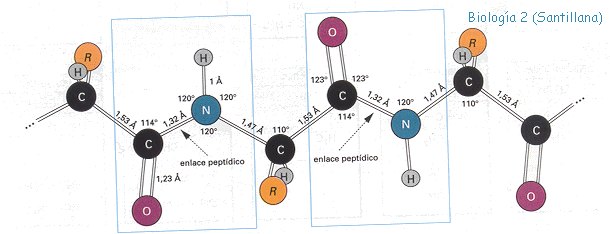
Un enllaç peptídic es un enllaç entre el grup amino d’un aminoàcid i el grup carboxil d’un altre aminoàcid. L’altre dia vàrem veure per sobre què significava cadascun d’aquests termes així que, amb una mica més de perspectiva, i sempre fent un petit acte de fe, podem imaginar que entre aquests dos grups químics que hem vist s’estableix un vincle que uneix els dos aminoàcids, en això consistiria l’enllaç.
Una dada important és que durant aquest procés hi ha pèrdua d’una molècula d’aigua com a conseqüència d’aquesta unió. El procés es pot donar per a combinar uns pocs o molts aminoàcids (depenent de quants tinguem direm que la longitud de la cadena és més o menys llarga), però en qualsevol cas, sempre ens quedarà en un extrem un grup amino i en l’altre un grup carboxil.
Crec que una imatge animada val més que mil paraules, no? 😉
Bé, suposo que al cap i a la fi tampoc hi havia tant a dir. El tema és que com a conseqüència d’aquesta unió entre els aminoàcids es va formant una estructura bàsica en forma de ziga-zaga, que representa el primer nivell d’organització de l’estructura de les proteïnes. Recordem que amb els 20 aminoàcids formadors de proteïnes, tenim 20n possibles combinacions, on n és el nombre d’aminoàcids, i al ser entre 80 i 300 com comentàvem, doncs fent quatre càlculs ràpids podem intuir que el nombre de proteïnes que es pot formar és quasi bé il·limitat.
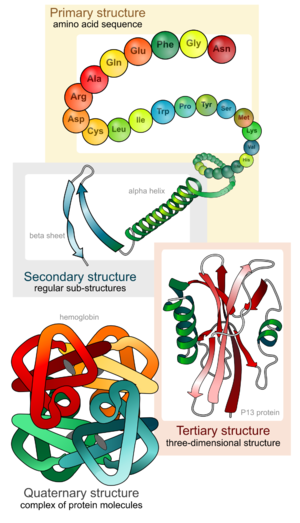
Tal i com s’intueix del subtítol que li hem donat, aquesta estructura s’anomena estructura primària. És la més important, ja que determina la resta d’estructures proteiques en els posteriors nivells d’organització, que ara veurem.
Estructura secundària
Segons els apunts:
És el plegament de la cadena polipeptídica degut a la formació de ponts d’hidrògen entre els grups -CO- i -NH- que formen l’enllaç peptídic (el primer com acceptor de H+ i el segon com a dador de H+).
Què vol dir? L’estructura primària anterior va adoptant una disposició espacial determinada a mesura que es van unint els seus aminoàcids. Això és conseqüència directa de la capacitat de gir que tenen els seus carbonis α. Ja varem veure que aquest carboni és el primer àtom (d’aquí lo de α “alfa”) que s’uneix a la cadena lateral. La qüestió és que per tal de mantenir estable l’estructura primària apareix un cert grau de rotació en la unió, que dota l’estructura d’estabilitat. Si és que la natura és tota una arquitecta de la vida!
Si fem un “zoom” per veure com acaba quedant la cosa, aquestes rotacions poden fer derivar l’estructura secundària en diversos tipus de forma, entre les quals podem trobar, com a principals:
 Hèlix alfa o α-hèlix
Hèlix alfa o α-hèlix
En aquest tipus d’estructura, la cadena polipeptídica s’enrotlla en espiral sobre si mateixa a causa dels girs que es produeixen entorn del carboni α de cada aminoàcid. L’estructura es manté gràcies als enllaços d’hidrogen intracatenaris formats entre el grup -NH i el grup -C=O del quart aminoàcid que el segueix. En formar l’hèlix, tots els grups -C=H queden orientats en la mateixa direcció, que és la contraria als grups -NH, i els radicals dels aminoàcids queden dirigits cap al exterior. La rotació té lloc cap a la dreta, de manera que cada aminoàcid fira 100º respecte de l’anterior.
Aquesta disposició fa que a cada volta de l’espiral hi hagi 3.6 residus. Aquest és un concepte que apareix a tot arreu (apunts inclosos, naturalment) i m’ha costat de pillar. Per a començar, “residu” no és més que la part del aminoàcid original que queda, un cop passat a formar part del pèptid (proteïna). Si us plau, si ho tinc mal entès, que algú em corregeixi. L’hèlix es repeteix exactament cada 18 residus, que conformen exactament cinc voltes. Per tant, aquest 3.6 és en realitat una mitjana (18/5 = 3.6) que ens ve a dir que a cada volta hi ha més o menys 3 o 4 aminoàcids.
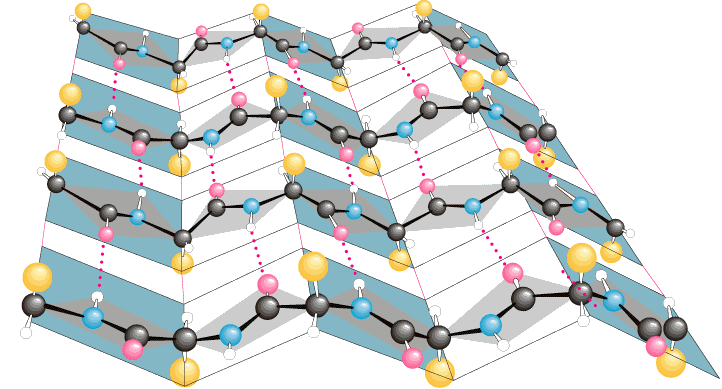 Làmina o fulla plegada beta (β)
Làmina o fulla plegada beta (β)
En aquest cas la cadena principal s’estira al màxim i permet que els enllaços covalents adoptin una estructura espacial anomenada estructura β (quina sorpresa, no?). La diferència respecte l’anterior seria que aquí les cadenes laterals dels aminoàcids es disposen a dreta i esquerra de l’esquelet principal, de manera alternada, i a més entre diverses cadenes o fins i tot entre les zones de la mateixa cadena es poden formar enllaços ponts d’hidrogen, de manera que això dona una estructura planera, d’aquí el seu nom de fulla plegada.
 Girs beta
Girs beta
Connecten seqüències de la cadena polipeptídica amb estructura α o β. Son seqüències curtes que fan que la cadena principal d’un polipèptid giri 180º. Jo ho interpreto com la manera d’ajuntar les hèlix α amb les fulles β per a conformar estructures mixtes, però vaja…
Entenc que això pot resultar summament complex -de fet jo tampoc ho entenc massa-. Qui estigui llegint això per curiositat segurament ja haurà passat pàgina i anat cap al final de l’entrada o a quelcom més divertit com veure la tele o jugar al Candy Crush Saga, però el qui estigui mirant això amb l’esperança d’entendre una mica millor la bioquímica de la carrera pot estar suant la gota freda. Especialment si ha anat fent clic als enllaços a la Viquipèdia, la cosa es complica bastant :S
Bé, no ens desanimem. No sé vosaltres però… jo penso treure’m la carrera igualment! O com a mínim no em rendiré per això xD. Al cap i a la fi, vull ser nutricionista, no físic nuclear. Cap al final us deixo algun vídeo que crec ens pot ajudar a digerir millor tot això. De moment, seguim veient les estructures de la proteïna.
Estructura súper-secundària (o domini)
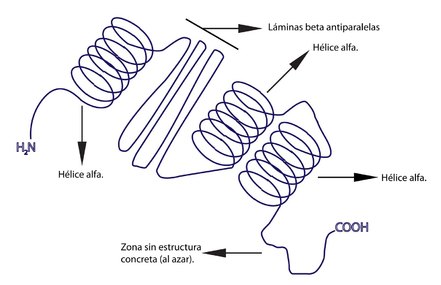 Aquí podem respirar més tranquils, aquest concepte és relativament senzill: és la combinació de les diferents estructures secundàries. Buah, tant de bo tot fos tant senzill!
Aquí podem respirar més tranquils, aquest concepte és relativament senzill: és la combinació de les diferents estructures secundàries. Buah, tant de bo tot fos tant senzill!
Una mica més d’info: aquesta combinació no es realitza a l’atzar sinó que, abans de donar lloc a l’estructura terciària (ja us acabo de fer un spoiler, la cosa continua…), la súper-secundària segueix una sèrie de patrons que es repeteixen entre els diferents tipus de proteïnes. Podrien estar formats per només hèlix, només làmines, o ambdues.
Estructura terciària
Es denomina estructura terciària d’una proteïna a la disposició espacial (tridimensional) de tots els seus àtoms. Ve donada per l’associació de diverses estructures súper-secundàries -de les que acabem de veure- en una única cadena polipeptídica. L’estructura terciària és específica de cada tipus de proteïna i és la que determina les seves propietats biològiques.
Això no surt als apunts però, en el curs de Coursera sobre els gens, recordo que es comentava que una petita alteració en una proteïna del nostre codi genètic -cosa que passa sovint- pot fer que al canviar la seva forma, la seva funció a l’organisme canvi totalment. Crec que podríem pensar en les proteïnes com claus. Hi ha un “fotimé” de possibles proteïnes com ja hem vist, i cada una d’elles té una funció molt específica, en el nostre símil, només obriria una porta. Si alteres una mica la forma de la clau, potser pots seguir obrint la mateixa porta, potser cap, o potser una de nova, amb les conseqüències que això implicaria.
Tornant als apunts: les proteïnes mantenen la seva estructura i funció dins de la cèl·lula mentre no hi ha un canvi en les condicions que provoqui que s’alteri. Hi ha diversos processos que poden alterar l’estructura de la proteïna, fent que les interaccions dèbils que mantenen l’estructura es trenquin (els enllaços covalents es mantenen, sembla), per exemple per la calor, els canvis en el pH, dissolvents o detergents. Aquest procés es coneix amb el nom de desnaturalització.
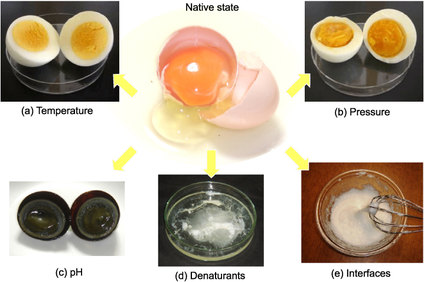 Aquest concepte potser li soni a algú, però aplicat a la cuina. Què succeeix quan escalfem un ou? A mesura que s’escalfa, l’aparença i les propietats de la clara de l’ou canvien, salta a la vista. Passa de transparent en estat natural a blanc i líquid quan el fregim, i blanc i dur quan el bullim. És un clar exemple de desnaturalització -en aquest cas de les proteïnes de l’ou (ovo-albúmines).
Aquest concepte potser li soni a algú, però aplicat a la cuina. Què succeeix quan escalfem un ou? A mesura que s’escalfa, l’aparença i les propietats de la clara de l’ou canvien, salta a la vista. Passa de transparent en estat natural a blanc i líquid quan el fregim, i blanc i dur quan el bullim. És un clar exemple de desnaturalització -en aquest cas de les proteïnes de l’ou (ovo-albúmines).
Segons l’estructura terciària, trobem dos tipus de proteïnes diferents:
- Proteïnes fibroses – Els elements de l’estructura secundaria no pateixen grans modificacions i mantenen el seu ordenament, per tant formen estructures en forma de fibra o làmina. La queratina i el col·lagen son dos exemples clàssics.
- Proteïnes globulars – Se succeeixen regions amb estructures a l’atzar, el que dóna lloc a una forma esfèrica. Per exemple la mioglobina.
Estructura quaternària
Quan la proteïna està formada per diverses cadenes polipeptídiques es diu que presenta una estructura quaternària. També se’n diu proteïna oligomèrica, perquè està conformada per diversos monòmers. Un monòmer = un polipèptid, o sigui una estructura terciària de les anteriors, i oligo ve del llatí ὀλίγος i significa “uns pocs”, per tant tenim que un oligòmer són uns pocs monòmers. Té el seu sentit.
Les estructures quaternàries s’estabilitzen a partir dels mateixos mecanismes que les terciàries, això és, a partir d’interaccions no covalents i enllaços disulfurs (yeah).
Actualment se sap que un gran nombre de proteïnes tenen estructura quaternària, sobretot les intracel·lulars. D’altra banda, en ocasions l’estructura quaternària està relacionada amb els processos de regulació. Així, formes actives i inactives dels enzims (ens falten per veure, són el següent tema!) es diferencien en la seva estructura quaternària.
Recapitulem
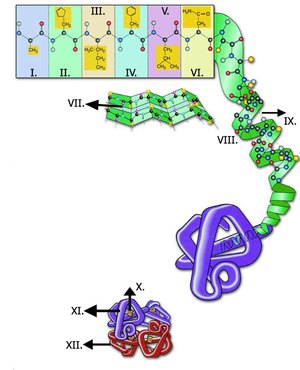
Una imatge val més que mil aminoàcids paraules. Com queda la història dels diferents nivells de la proteïna?
 Uhmmm… d’acord, m’he colat de personatge xD. Però bé, potser ens podria resultar útil el símil: són quatre nivells al cap i a la fi, i cadascun super-cedeix al anterior.
Uhmmm… d’acord, m’he colat de personatge xD. Però bé, potser ens podria resultar útil el símil: són quatre nivells al cap i a la fi, i cadascun super-cedeix al anterior.
Va, ara si, els diferents nivells estructurals de la “súper proteïna” (imatge de la dreta)
- Estructura primària
- Estructura secundària
- Estructura terciària
- Estructura quaternària
Si et preguntes si calia tornar a enumerar les estructures, quan són més que evidents a aquestes alçades, la respostes és: no, però és que em quedava un espai en blanc lleig fins al següent punt de l’entrada 😛
Classificació de les proteïnes
Indirectament, hem vist ja dues de les maneres en les que es poden classificar les proteïnes. Segons criteris estructurals, hem parlat de proteïnes globulars i fibroses. També hem parlat de proteïnes monomèriques i oligomèriques, això seria des d’un punt de vista del nombre de cadenes peptídiques que la conformen. Tenim dos criteris més:
- Atenent a la seva solubilitat – podem trobar:
- Albúmines – Són solubles a l’aigua o en dissolucions salines diluïdes
- Globulines – Són solubles en dissolucions salines més concentrades
- Prolamines – Són solubles en l’alcohol
- Glutelines – Només es dissolen en dissolucions àcides o bàsiques
- Escleroproteines – Són les que ja hem anomenat abans com a fibroses, són insolubles en la gran majoria de dissolvents
- Segons criteris químics:
- Proteïnes simples – Formades només per alfa aminoàcids. Per exemple, la ubiquitina.
- Proteïnes conjugades – Contenen, a més de la cadena polipeptídica, un component no amino-acídic anomenat grup prostètic, que podria ser un sucre, un lípid, un àcid nucleic o un ió inorgànic. Quan no disposa del grup prostètic no és funcional i s’anomena apoproteïna. Quan si ho està és funcional i s’anomena holoproteïna. Exemples: la hemoglobina, mioglobina, citocroms, etc.
En el post d’avui no entrem en classificacions de les proteïnes des d’un punt de vista més popular i tradicional de l’àmbit de la nutrició, com podria ser si són d’origen animal o vegetal, d’alt valor biològic o no, completes o incompletes (pel nº d’aminoàcids essencials que contenen), etc. Seria interessant, de fet, però no em vull sortir de l’àmbit de l’assignatura de bioquímica, per no liar la troca.
En tot cas, una foto que dóni un aire més nutricional a la entrada no estaria de més, que no en té massa pinta, oi? Penseu en algun dels aliments que consumim, per exemple la carn -no processada i de pastura, naturalment- doncs com la majoria ja sabem està formada per altes quantitats d’aquestes proteïnes, que a l’organisme s’acaben descomposant a través de la digestió en els aminoàcids finals, i que el cos utilitzarà per a fer les seves funcions, sintetitzar les seves pròpies proteïnes (algunes ja les hem mencionat, com la hemoglobina de la sang), etc…

Funcions
Acabem amb una enumeració breu de les funcions de les proteïnes a l’organisme. Recordem que juguen un paper fonamental per a la vida (de fet, en grec “proteios” πρωτεῖον significa “en primer lloc” o “primordial”) i com hem vist, són les biomolècules més versàtils i diverses. Són imprescindibles pel creixement de l’organisme (recordem, totxanes del cos) i realitzen un munt de funcions diferents, entre les quals podem destacar:
- Estructural – La funció més característica, com hem vist
- Immunològica o defensiva – Actuen com a anticossos que combaten els elements ofenedors (antigens) que es colen al organisme són proteïnes (concretament, són les immuno-globulines)
- Enzimàtica – Catalitzen reaccions químiques de l’organisme. Com deia abans, això és el següent tema i espero dedicar-li una entrada
- Contràctil o energètica – Això espero que es tocarà en un tema apart, podeu estar segurs que tindrà una entrada dedicada al blog donada a la importància que té en la musculació, de fet és la base (miosina i actina)
- Homeostàtica – Regulen l’equilibri osmòtic i actuen com a tampó químic (manteniment constant del pH del medi intern)
- Transductora de senyals o transport – Són les que transporten senyals de l’0rganisme que porten informació per als seus receptors. Segur que veurem això amb més detall, ja hem parlat algun cop sobre els receptors de la leptina (ja la trobaves a faltar?), la insulina, la seva resistència, etc. Potser ja podem començar a lligar una mica el tema! Quan això passa sol ser perquè o bé els transmissors es regulen a la baixa (retroalimentació negativa) o bé els seus receptors perden sensibilitat, es saturen abans, etc.
- De reserva – Per exemple per a alimentar l’embrió en l’òvul (la ovoalbúmina que ja hem vist), les de la llet o la ferritina per a les reserves de ferro a l’organisme
I bé! Fins aquí hem arribat, en el que representaria un 101 sobre la bioquímica bàsica de la proteïna. Naturalment hi ha material per a donar i vendre.
Això em fa pensar en que us dec un vídeo. Ahí va, us deixo alguns que m’han agradat. Un en castellà i 3 en anglès perque, la veritat, en anglès són molt millors, ho sento 0: ) Tampoc he rebuscat gaire, així que si teniu alguna aportació interessant, me la podeu fer arribar 😉
Apa, espero que us hagi ajudat a comprendre què és exactament una proteïna!










